
脑脊液是动物实验研究中经常使用的标本,在脑损伤机制,生物标志物和药物治疗等研究领域具有不可替代的研究价值。但是,大鼠心室和蛛网膜下腔狭窄,内部血管丰富。脑脊液收集的成功率低是许多研究人员面临的技术问题,因为提取脑脊液的过程很复杂,并且将延髓穿刺致死。 通过参考文献并改进先前报道的收集脑脊髓液的方法,该研究提供了一种准确,方便,快速,无血的大鼠脑脊髓液收集方法。 .. 1、实验材料1、选择上海实验动物中心提供的SD大鼠20只作为实验动物,体重300-400g。
2.实验设备脑立体定位设备,微量注射器(100μl),水合氯醛,手术设备,冷冻离心机(CT15RE)。
2.实验方法和结果(1)实验方法
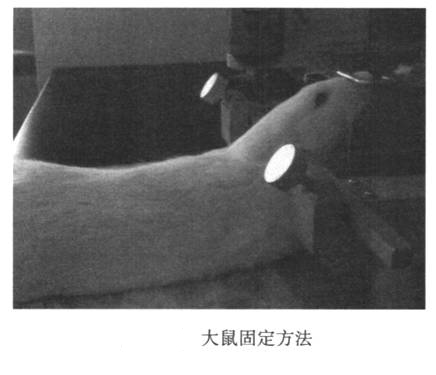
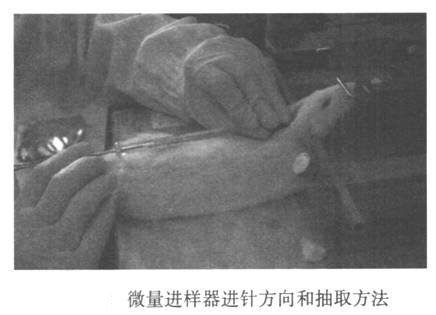
腹膜内用7%水合氯醛麻醉大鼠。麻醉动物后,将立体定向设备的耳杆插入两个耳道的耳朵附近,将耳杆固定到主机架上,并且两侧的耳杆读数相同。钩住大鼠的上门牙棒以固定上颚。抬起前牙杆。将大鼠的头和身体摆到大约135°(图24-1)。切开大鼠的头枕并进行灭菌,并沿后中线做一个垂直切口(1.5-2厘米)。张开皮肤可发现枕骨后方的三角肌间隙倒置。使用微型注射器的尖端推动三角形凹口的底部,并使其沿后中线滑动,并在到达孔口大孔时插入针头。主体是平行的。也就是说,针和头部之间的角度约为135°(图24-2)。请注意,进针速度不要太快。当针尖穿透黄韧带时,会有明显的脱落感。此时,针尖进入大水箱(深度为0.2毫米)。停针。左手固定针的头部不动,右手慢慢抽出脑脊液,这时,如果抽出速度慢,血液很容易流出,因此要小心。提取后,迅速取下针头,将脑脊液转移到0.5 ml EP管中,离心,立即用液氮或干冰冷冻,然后转移到-80°C的冰箱中储存。收集脑脊髓液后,可以缝合或处死皮肤以进行随访,然后继续饲养动物。
(2)标准
在4℃20分钟内以2000g离心收集的脑脊液10分钟。如果脑脊髓液呈淡红色,则表示血脑脊髓液和溶血:如果EP管底部有红色沉淀物,则表示血脑脊液,但未发生溶血嗯含有血性脑脊髓液的样品被认为不合格。
(3)结果
在20只大鼠中,有18只成功提取了脑脊液,离心后,脑脊液清澈透明,没有红色沉淀。通常,大鼠可以提取80-120μl的脑脊髓液,较大的大鼠可以收集120-140μl的脑脊液。两只动物的脑脊液呈血性,但离心后可得到80μl或以上的透明脑脊液。
3.讨论
分析脑脊液中的相关成分是动物研究中的一种常用方法,因为脑脊液中的成分可以间接反映脑组织的状态。但是,由于脑脊液的收集方法和技术有限,动物研究常常提出一个难题。如何在收集足够的脑脊液的同时避免血液污染是成功提取脑脊液的关键。在许多先前报道的脑脊液收集方法中。血性脑脊液的出现是一个经常困扰研究人员的主要问题。快速学习有效的脑脊液收集方法,尤其是对于初学者,是后续治疗的关键。目前,在日本和国外报道的收集脑脊液的方法主要包括直接对大水罐进行经皮穿刺,在直视下对大水罐进行硬膜穿刺以及对穿刺硬脑膜进行直接可视化。这将是。基于以前的
报告,作者的研究团队调整了提取方法,以建立更适合初学者的方法。与直接从皮肤收集脊髓液的方法相比,微型注射器的位置更容易掌握,操作偏差也较小。与在直视下打开皮肤和肌肉以收集脑脊液相比,简单地切割皮肤可以防止对肌肉的损害并减少出血造成的肌肉污染。同时,如果您是初学者,但由于熟练程度差而无法从*次插入针头成功撤回脑脊液,肌肉的收缩和密封功能将导致第二次或第三次改变针头的方向或位置。可以调整。为避免*次在直视下无法排出脑脊液,拔掉针头后脑脊液的排出很严,不能再次取出未受污染的样品。另外,如果动物需要继续进食,则通过简单地张开皮肤通过延髓通过肌肉穿刺来提取脑脊髓液的方法比直接张开皮肤和肌肉的方法更具侵入性。它具有主要优势,例如小范围和快速恢复动物。总之,作者研究并建立了如何通过肌肉穿刺来打开皮肤和穿刺脑脊液以提取脑脊液的方法。这具有简单,快速和高效的优点。这是收集脑脊液的极好方法,特别适合不熟悉脑脊液的患者。