
他,8篇Natrue+2篇Science+3篇Cell

李晓淳,2004年开始在清华大学求学,师从施一公院士。在清华大学的学习期间,他就展现出了卓越的科研探索能力,专注于蛋白质结构与功能的研究领域。
2012年获得博士学位后,李晓淳前往美国洛克菲勒大学,加入了1999年诺贝尔生理学或医学奖得主Günter Blobel教授的实验室,开展博士后研究工作并赢得了三机构(纪念斯隆凯特琳癌症研究中心,洛克菲勒大学和威尔康奈尔医学)初级研究人员突破奖。
2017年,他加入德克萨斯大学西南医学中心担任分子遗传学系助理教授,在Joseph Goldstein和Michael Brown教授(1985年诺贝尔生理学或医学奖得主)的领导下,继续使用结构技术研究胆固醇代谢和溶酶体储存疾病的相关路径。
截至目前,李晓淳团队发表了40余篇该水平论文,今年的研究成果依旧丰硕,已发4篇,影响因子总计超122!(可添加小编微信获取全文哦~)
01
Cell (IF=45.5)
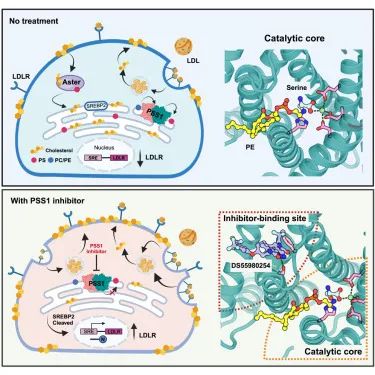
10月3日,李晓淳作为唯一通讯作者在顶级期刊《Cell》发表了一篇题为“Molecular insights into human phosphatidylserine synthase 1 reveal its inhibition promotes LDL uptake”的研究论文。该研究揭示了哺乳动物PS合成的机制,并表明选择性的PSS1抑制剂有可能降低血液胆固醇水平。

标题:人类磷脂酰丝氨酸合成酶1的分子见解揭示其抑制促进LDL摄取
研究内容:
在哺乳动物细胞中,两种磷脂酰丝氨酸(PS)合成酶驱动PS的合成。Ptdss1基因的功能获得性突变导致PS产量增加,引起Lenz-Majewski综合征(LMS)。此前药理学抑制PSS1已被证明可以抑制肿瘤发生。
该研究首次报告了野生型人类PSS1(PSS1WT)、导致LMS的Pro269Ser突变体(PSS1P269S)以及与抑制剂DS55980254复合的PSS1WT的冷冻电镜结构。PSS1包含10个跨膜螺旋(TMs),其中TMs 4-8构成了位于腔侧小叶中的催化核心。这些结构揭示了PSS1的工作机制类似于推测的膜结合O-酰基转移酶家族的机制。此外,研究发现PS和DS55980254都能别构抑制PSS1,并且DS55980254的抑制作用激活了SREBP途径,从而增强了LDL受体的表达并增加了细胞对LDL的摄取。这项工作揭示了哺乳动物PS合成的机制,并表明选择性的PSS1抑制剂有可能降低血液胆固醇水平。
02
Trends in Biochemical Sciences(IF=11.6)
10月22日,李晓淳研究团队在《Trends in Biochemical Sciences》发表了题为“Clues into Wnt cell surface signalosomes and its biogenesis”的综述文章,

标题:Wnt细胞表面信号体及其生物起源的线索
研究内容:
Wnt形态发生素通过与其细胞外受体结合诱导信号传导。本文讨论了几项最新的结构研究,展示了Wnt与受体frizzled(FZD)和低密度脂蛋白受体相关蛋白5/6(LRP5/6)的相互作用,Cachd1作为Wnt信号传导的替代启动子发挥的作用,以及脂化Wnt是如何在细胞内产生并分泌出去的。这些研究增进了我们对Wnt信号通路及其调控机制的理解。
03
Nature communications (IF=14.7)
5月23日,李晓淳作为通讯作者在《Nature communications》上发表了题为“Structure and inhibition of the human lysosomal transporter Sialin”的文章。

标题:人溶酶体转运蛋白唾液酸蛋白的结构和抑制作用
研究内容:本研究通过低温电子显微镜技术呈现了人Sialin的四种结构状态:无配体胞质开放态、无配体腔开放态、NAAG结合态和抑制剂结合态。结构显示,带正电的胞质开放前庭可以容纳NAAG或Sialin抑制剂Fmoc-Leu-OH,而其腔内空腔可能结合唾液酸。此外,功能分析与分子动力学模拟识别出结合唾液酸和NAAG的关键残基。
综上,该研究通过解析Sialin的不同结构状态,揭示了其如何通过不同的机制同时转运唾液酸和神经递质的机制,为深入了解溶酶体运输系统的功能和相关疾病的发病机制,开发治疗溶酶体贮积症的药物提供了重要的结构和功能基础。
04
Nature
9月25日,华盛顿大学David Baker团队在 Nature发表了题为“Designed endocytosis-inducing proteins degrade targets and amplify signals”的文章,李晓淳副教授为参与作者。

标题:设计的内吞诱导蛋白降解靶标并放大信号
研究内容:
本文介绍了一种新的计算设计方法——EndoTags,用于克服现有治疗方法在靶向蛋白质降解时遇到的限制。EndoTags能够与目标蛋白结合物融合,有效地引导溶酶体运输和目标降解,尤其适用于那些缺乏能刺激内吞作用的天然配体的受体。研究展示了针对多种受体的EndoTags,证明了其在不同组织中实现特异性降解的能力。此外,EndoTags还展示了提高工程配体-受体系统信号传导效率的潜力,具有广泛的治疗应用前景。