
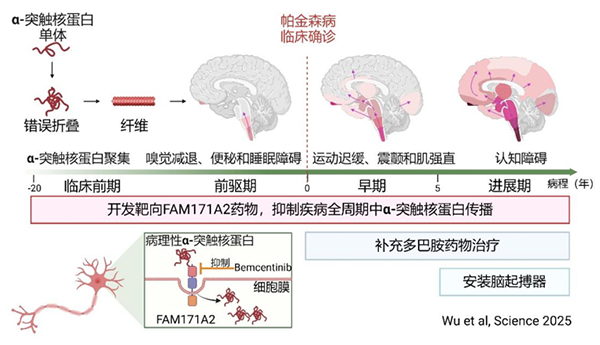
图 FAM171A2促进帕金森病的发生发展机制
在国家自然科学基金项目(批准号:82271471、82401676、92249305)等资助下,复旦大学附属华山医院郁金泰教授团队联合复旦大学脑科学转化研究院袁鹏教授团队、中科院上海有机化学研究所生物与化学交叉研究中心刘聪教授团队在帕金森病发病机制研究方面取得进展。研究成果以“神经元FAM171A2介导α-突触核蛋白纤维摄取并促进帕金森病发生(Neuronal FAM171A2 mediates α-synuclein fibril uptake and drives Parkinson's disease)”为题,于2025年2月20日在线发表于《科学》(Science)杂志,论文链接:https://www.science.org/doi/10.1126/science.adp3645。
帕金森病(Parkinson's disease, PD)是第二常见的神经退行性疾病,我国65岁以上老年人群中帕金森病患病率为1.7%,到2030年,我国帕金森病患者数预计将达500万,几乎占到全球患者数的一半。既往研究发现α-突触核蛋白在病理条件下会发生错误折叠并聚集形成病理性α-突触核蛋白,破坏神经元功能并导致其死亡,是PD的关键致病蛋白。这些致病蛋白还会像“种子”一样播散,入侵邻近神经元,募集神经元内α-突触核蛋白单体发生错误折叠,形成更多的致病“种子”。这些致病“种子”可以在神经元间传播,当传播到中脑黑质区域时,可导致多巴胺能神经元死亡,从而出现动作迟缓、静止性震颤、肌强直等PD运动症状。但目前病理性α-突触核蛋白在神经元间传播机制尚不清楚,临床仍然缺乏有效干预手段。
研究团队首先通过大规模人群的全基因组关联分析,发现FAM171A2是PD风险基因;并基于PD患者临床样本分析发现,患者大脑中FAM171A2蛋白含量增高,且FAM171A2含量越高的患者,其脑内病理性α-突触核蛋白含量也越高。进一步研究发现在神经元细胞膜上,FAM171A2可选择性的结合病理性α-突触核蛋白,并携带其进入到神经元中,诱导神经元内单体形式的α-突触核蛋白发生错误折叠,造成神经元死亡和其在神经元间的传播。团队随后研究证实敲除小鼠神经元上FAM171A2,可以有效控制小鼠帕金森样症状的进展。基于前述发现,研究团队利用人工智能的蛋白结构预测和虚拟筛选技术,从7000余种药物中成功筛选出候选小分子bemcentinib,并在体外实验和动物实验证实该小分子可有效抑制FAM171A2蛋白和病理性α-突触核蛋白结合,并抑制多巴胺能神经元对病理性α-突触核蛋白的摄取(图)。
本研究发现了神经元上病理性α-突触核蛋白潜在膜受体FAM171A2蛋白,揭示了FAM171A2蛋白是促进病理性α-突触核蛋白传播的关键,筛选出FAM171A2有效阻断剂bemcentinib是治疗PD的候选小分子。该研究结果为PD的治疗提供了潜在新靶点和新思路。