
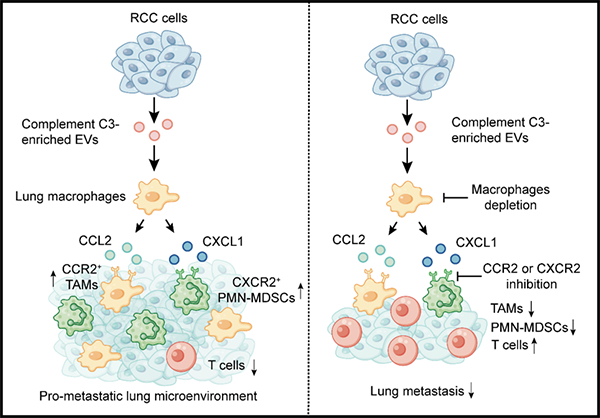
图 细胞外囊泡C3促进转移和招募免疫抑制型骨髓细胞的功能模式图
在国家自然科学基金项目(批准号:82025029、82150114、82430094)等资助下,东南大学高山教授课题组在肿瘤细胞来源外囊泡促转移研究方面取得进展。研究成果以“肿瘤细胞来源外囊泡C3通过招募髓性免疫抑制细胞促进肾癌细胞转移(Complement C3 of Tumor-derived Extracellular Vesicles Promotes Metastasis of RCC via Recruitment of Immunosuppressive Myeloid Cells)”为题,于2025年1月 23日在线发表于《美国国家科学院院刊》(Proceedings of the National Academy of Sciences of the United States of America)杂志。论文链接为:https://www.pnas.org/doi/10.1073/pnas.2420005122。
C3是补体系统的中心效应分子,通过经典途径、凝集素途径或旁路途径被激活后,产生活性片段C3a和C3b,这些片段不仅参与免疫反应,也在肿瘤发生发展中发挥重要功能。C3a/C3aR轴通过破坏上皮细胞间的紧密连接、激活肿瘤相关成纤维细胞和招募中性粒细胞促进肿瘤转移,但是补体系统影响肿瘤进展和免疫微环境的机制还有很多的未知等待探索。肿瘤细胞分泌的因子,尤其是细胞外囊泡(extracellular vesicles,EVs),在转移前生态位形成过程中发挥着重要功能。形成过程包括血管泄漏、造血、细胞外基质重塑和免疫抑制微环境产生。目前,关于EV C3在肿瘤转移以及转移前生态位形成过程中的具体功能和作用机制尚不明确。
该研究利用定量质谱分析比较了肾细胞癌转移细胞和原位细胞分泌的EV蛋白质丰度,发现补体C3在转移细胞系的EVs中含量升高。在功能方面,在免疫缺陷小鼠体内C3不影响转移,但是在免疫健全小鼠体内C3促进转移,说明C3在体内的促转移作用依赖于免疫系统。在分子机制上,EV C3被肺转移部位的巨噬细胞吸收,促进该细胞分泌趋化因子CCL2和CXCL1,它们分别负责招募肿瘤相关巨噬细胞和多形核骨髓来源免疫抑制细胞。利用小分子抑制剂阻断CCL2/CCR2和CXCL1/CXCR2轴后,C3的促招募和促转移作用被抑制。临床上,高表达C3的肾细胞癌病人的总生存期和无进展生存期比低表达C3的病人短(图)。
此项工作揭示了肾癌来源EVs关键分子C3在促转移过程中的分子机制,为肾癌转移的免疫治疗提供了新靶点和理论支持。