
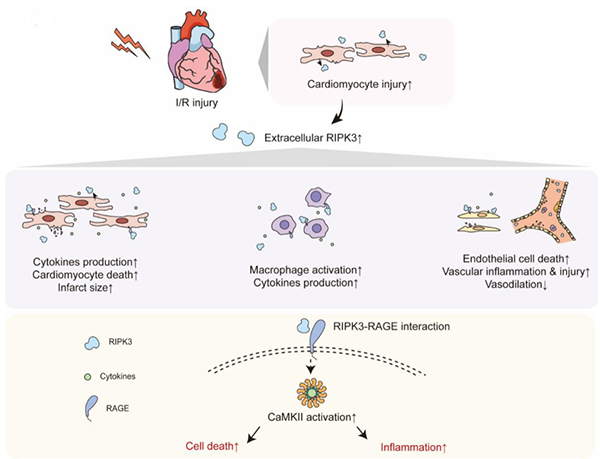
图 细胞外RIPK3通过RAGE-CaMKII通路加重心脏缺血/再灌注损伤
在国家自然科学基金项目(批准号:82325004、92168114、82300286、92168113、82370458、82270405)等资助下,北京大学张岩研究员、董尔丹教授联合北京协和医院张抒扬教授、胡晓敏副研究员团队,在心脏缺血/再灌损伤研究方面取得进展。研究成果以“细胞外RIPK3作为损伤相关分子模式加重心脏缺血/再灌损伤(Extracellular RIPK3 acts as a damage-associated molecular pattern to exaggerate cardiac ischemia/reperfusion injury)”为题,于2024年11月26日在《循环》(Circulation)杂志上发表。论文链接:https://www.ahajournals.org/doi/abs/10.1161/CIRCULATIONAHA.123.068595。
心脏缺血/再灌注(ischemia/reperfusion,I/R)损伤是缺血性心脏病治疗的重要靶点,尚无有效的治疗方法来减少心脏I/R损伤。损伤相关分子模式(Damage-associated molecular patterns,DAMPs)是细胞损伤后释放的内源性分子,能够加剧组织炎症和损伤。受体相互作用蛋白激酶3(receptorinteracting protein kinase 3,RIPK3)是一种细胞坏死和炎症的内源性介导分子,可在外周血中被检测到,并作为多种疾病的生物标志物。然而,细胞外RIPK3是否在心脏I/R损伤中发挥生物学功能仍然未知。
本研究发现,在接受经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)手术的急性心肌梗死(acute myocardial infarction,AMI)患者中,血浆RIPK3浓度与短期(3个月)和长期(5年)主要不良心血管事件(major adverse cardiovascular event,MACE)的发生呈正相关,提示RIPK3是风险分层的重要生物标志物。在培养的细胞和体内小鼠模型中,重组RIPK3蛋白作为新型DAMP,通过作用于心肌细胞、炎症细胞和内皮细胞,引发细胞损伤、炎症反应和功能紊乱,进而参与心肌I/R损伤的发生。通过靶向细胞外RIPK3或其下游晚期糖基化终末产物受体(receptor of advanced glycation end-products,RAGE)-钙/钙调蛋白激酶II(Ca2+/calmodulin-dependent kinase II CaMKII)信号通路,有望为心肌I/R损伤及其相关并发症的防治提供新的策略(图)。
该研究揭示了血浆RIPK3浓度与AMI患者PCI治疗后发生主要不良心血管事件的风险呈正相关,为AMI患者的风险分层提供了新的生物标志物,并为临床治疗心脏I/R损伤提供了潜在的治疗靶点。