
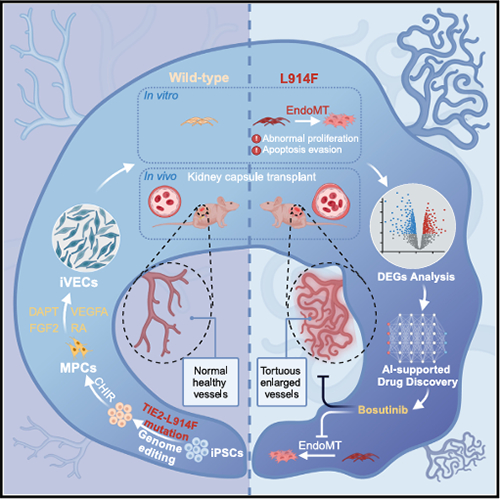
图 高效的静脉内皮细胞(iVEC)分化方案
在国家自然科学基金项目(批准号:82370514、82472171)等资助下,北京大学王凯研究员、孔炜教授、王茜研究员以及谢正伟研究员团队在诱导多能干细胞用于血管畸形建模和药物发现研究方面取得进展。研究成果以“诱导多能干细胞衍生的人静脉内皮细胞用于血管畸形建模和药物发现(Generation of iPSC-derived human venous endothelial cells for the modeling of vascular malformations and drug discovery)”为题,于2024年11月22日在《细胞·干细胞》(Cell Stem Cell)杂志在线发表。论文链接:https://www.sciencedirect.com/science/article/pii/S1934590924003771?via%3Dihub。
静脉畸形(Venous malformations,VMs)是常见的血管异常,主要因为静脉内皮细胞(venous endothelial cells,VECs)中的非遗传性体细胞突变所致。目前缺乏成熟的VMs疾病模型,严重阻碍了治疗VMs药物的发现。
该研究团队开发了一种高效生成人诱导静脉内皮细胞(induced VECs,iVECs)的方法,利用基因编辑技术在诱导多能干细胞(induced pluripotent stem cells,iPSCs)的TIE2基因座中引入了L914F突变,并证明突变的iVECs在移植至小鼠后形成扩张的血管,从而重现了VMs的表型特征,包括细胞骨架紊乱、增殖能力增强及成管腔能力减弱。此外,团队通过结合深度神经网络与高通量数字化RNA基因扰动测序(digital RNA with perturbation of genes sequencing,DRUG-seq)技术,进行了药物筛选,发现了一种潜在治疗VMs的药物博舒替尼(Bosutinib),通过减弱突变型iVECs内皮间质转化,抑制细胞增殖,有效改善了VMs疾病表型。该研究团队利用基因组编辑与干细胞技术构建了VMs疾病模型,为进一步开发治疗VMs的新型药物奠定了基础(图)。
本研究不仅完善了VMs疾病的模拟体系,还为VMs的治疗提供了潜在的临床药物靶点,进一步拓展了干细胞技术在血管疾病研究中的应用前景。