
癌症转移是指癌细胞从原发肿瘤部位脱离,通过血液或淋巴系统传播到身体其他部位,并在这些新位置形成新的肿瘤的过程。这一过程是导致多数癌症相关死亡的主要原因。转移过程通常包括以下几个步骤:局部侵袭、血管内渗(进入血液循环)、生存于循环中、血管外渗(离开血液循环进入目标组织)以及在新位置的生长和增殖。
尽管已知某些脂质相关的变化对于癌细胞的外渗至关重要,但关于具体哪些脂质成分支持癌细胞在新环境下的存活与生长仍有很多未知之处。
2024年11月25日,西湖大学邹贻龙、王曦团队与南京妇幼保健院曹剑医生合作,在国际顶尖学术期刊《Cell》上发表了一篇题为“ACSL4 and polyunsaturated lipids support metastatic extravasation and colonization”的研究论文。
西湖实验室助理研究员王煜棋博士、博士生胡鋩泽及南京市妇幼保健院/南京医科大学附属妇产医院曹剑医生为论文共同第一作者。
该研究揭示了多种癌症中转移潜力与铁死亡敏感性之间的关联,从卵巢癌患者中分离出的转移灶来源的癌细胞相比于原发肿瘤来源的细胞表现出更高的铁死亡敏感性和多不饱和脂肪酰(PUFA)-脂质含量。进而发现ACSL4促进血液传播转移,能为治疗发展提供了新的靶点。

研究亮点
泛癌症表型数据挖掘揭示了转移-铁凋亡敏感性相关性
以代谢为重点的体内CRISPR筛选揭示了ACSL4在促进转移中的作用
ACSL4通过增强膜流动性及侵袭能力促进转移性外渗
高UFA-脂质的肿瘤细胞依赖ECI1/ECH1进行β-氧化和转移

研究内容
此前研究发现,到达远端器官的癌细胞可能已经进化出了有利于其在循环和外渗过程中存活的最佳脂质代谢谱型。这些癌细胞通过激活线粒体生物发生和氧化磷酸化来满足低营养环境下的高能量需求。β-氧化在这个过程中起着关键作用。
β-氧化是脂肪酸在一系列酶的作用下,在α碳原子和β碳原子之间断裂,生成乙酰辅酶A(CoA),和较原来少两个碳原子的脂肪酰辅酶A。β氧化以高通量的CoA为线粒体提供燃料,因此在支持体内癌细胞生长中发挥关键作用。
研究团队通过对泛癌症表型数据库的分析,发现具有高转移潜力的某些癌症类型(如卵巢癌、肝癌和头颈部癌)对铁凋亡诱导表现出更高的敏感性。进一步的研究证实了转移性肿瘤细胞中铁凋亡易感性和多不饱和脂肪酰基(PUFA)-脂质含量的增加。
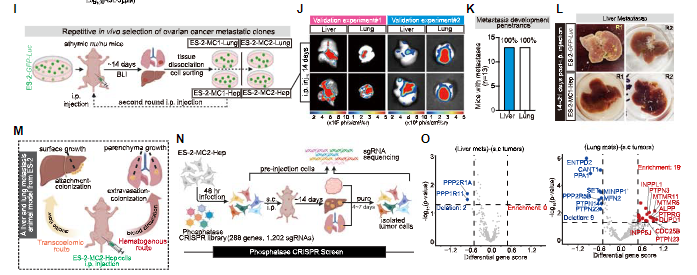
随后通过体内CRISPR筛选,在建立的卵巢癌远端转移小鼠模型中,研究人员发现了几种促进转移的代谢基因,包括参与NAD产生的NMNAT 1和参与PUFA-脂质生物合成的ACSL 4。其中,ACSL 4能通过增强膜流动性和促进迁移来特异性介导血源性播散过程中的转移性外渗。
而ACSL 4耗竭实验终,ARA(一种丰富的PUFA)预处理提高ES-2-GFP-Luc亲代细胞的PUFA-脂质含量,在静脉内植入后增加了小鼠中的肿瘤转移外渗率。
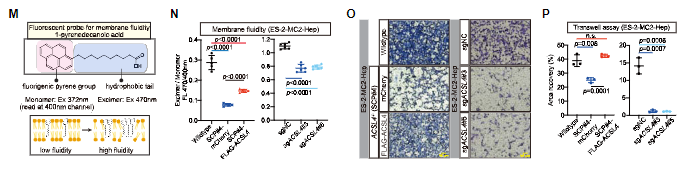
研究人员发现,ACSL4通过促进多不饱和脂肪酸(PUFA)向酰基辅酶A(acyl-CoA)的酯化,从而增强铁死亡过程。此外,具有高PUFA-脂质含量的转移性癌细胞依赖于不饱和脂肪酸(UFA)的β-氧化在肿瘤微环境中生存。
而MDH1、ABHD6、ECI1和ECH1是参与UFA β-氧化的关键限速酶,在准备UFA进行代谢分解中发挥重要作用。
研究人员发现,阻断UFA酯化(通过ACSL4)和β-氧化(通过ECH1)可以显著减少转移性肿瘤的生长和定殖。且这种联合抑制策略不仅适用于特定的癌症类型,如卵巢癌,也适用于其他类型的癌症,如黑色素瘤。

总而言之,这些提示了可能通过靶向脂质代谢途径来抑制癌症转移。此外,该研究还展示了这种策略在不同癌症类型和免疫活性环境中的广泛适用性,为进一步的临床应用奠定了基础。
这篇文章也是科研学者与临床医生强强联合的产物。临床医生在进行科研时具有天然的优势。他们直接面对患者,了解真实的临床需求,能够将临床问题转化为科学研究的课题。而通过与基础研究学者合作进行深入的基础研究,能将研究成果迅速应用于临床实践,加速成果转化,为患者带来更有效的治疗方案。
随着科研型医生不断地涌现,在科研界的地位会越来越高。未来,我们有理由相信,这种临床与科研紧密结合的模式将为医学领域带来更多的突破和创新。