
RAPD技术是实验动物分子遗传标记常用方法之一,由于其快速、简单、方便、经济、规范等优点,在动物、植物、微生物种属鉴定、亲缘关系的划分及多态性分析中得到广泛应用。但因为RAPD技术对实验条件要求十分严格,RAPD反应结果受到诸多因素的影响,如Mg2+、dNTP、模板、Taq DNA聚合酶(以下简称Taq酶)、反应时间、反应温度、所使用的仪器设备型号等。在实验中可能发生的问题及解决的方法介绍如下:
1.无扩增 ①可能因为在部分或全部管中缺少一部分反应物,重复少量几个反应以确定所有的PCR组分是否都已加入;②PCR抑制物可能与DNA一起纯化,改变DNA的浓度;③在DNA分离过程中加入一个清洗步骤(如酚抽提);④稀释新的DNA溶液;⑤引物母液失效,重新配制母液,使用不同的引物或提高引物浓度;⑥延长退火时间,或降低升温转换步骤之间的速率;⑦提高每个反应中的Taq DNA聚合酶的浓度;⑧补加新的组分,该组分需高压灭菌。
2.扩增结果差,条带模糊难以辨认 ①更换Taq DNA聚合酶缓冲液;②检查引物,使用另一个引物,或者将引物末端标记,在含6mol/L尿素、胶浓度为16%(质量浓度)的聚丙烯酰胺凝胶上电泳检测;③检查Taq DNA聚合酶活性(与不同批量的酶比较);④改变DNA浓度。
3.高分子质量产物(>4kb)呈弥散状分布 ①降低DNA浓度;②降低Taq DNA聚合酶浓度;③减少上样量;④可能是由于循环次数过多,减少循环次数;⑤确认是否使用正确的缓冲液制备凝胶;⑥在较低的电压下电泳。
4.带谱不可重复 DNA过多或过少都会影响扩增带谱。把基因组DNA浓度控制在10~100ng范围之内,DNA量太少时,“真正”靶序列与引物的结合效率低,因此引物扩增会产生假的条带,这就称为引物伪迹;DNA量太多会导致错误配对(指引物与基因组DNA的配对)。每个样品进行两个不同DNA浓度的反应。
5.影响RAPD图谱重复性的因素 RAPD图谱对实验程序和条件的变化很敏感。在同一个实验室中RAPD的可靠性和可重复性较高,而不同实验室之间RAPD的可比性却较差。一般影响条带的数目、大小和强度的因素有PCR缓冲液、dNTP和Mg2+浓度、循环参数(退火温度、变温时间、PCR仪)、Taq DNA聚合酶来源、DNA浓度、引物浓度。一般情况下:①每个反应所需DNA模板浓度为20~80ng;②dNTP浓度为100~200μmoL/L。在PCR热循环过程中,每种dNTP的终浓度为20~200μmol/L时,产物量高,特异性、忠实性较好;③Taq DNA聚合酶浓度在PCR中的用量受到反应体积、酶活性、酶耐热性等因素的制约,在条件合适时,每25μl体系中一般使用1~1.5U的raq DNA聚合酶。Taq DNA聚合酶用量过多时会引起非特异性扩增,从而在胶上出现比较深的背景,影响结果的检测,因此Taq DNA聚合酶的用量不宜过大;④退火温度的影响。退火温度对PCR的特异性十分关键,过高会使引物和模板结合不上,过低会使引物和模板非特异结合,使扩增片段的特异性下降。引物退火所用的温度取决于引物碱基的组成、长度和浓度,合适的退火温度应低于引物在PCR条件下真实Tm(melting temperature,解链温度)值5℃。
针对RAPD实验过程中可能遇到的问题,结合我们的课题,对中国地鼠RAPD分析体系反应中的几个主要影响因素进行了优化,确定*佳反应条件,以便获得稳定的扩增结果,为进一步用RAPD技术对中国地鼠的遗传研究奠定基础。具体实验如下:
(一)材料和方法
1.材料 中国地鼠近交E家系和A家系,随机各取12只作为实验材料。由山西医科大学实验动物中心提供。
2.试剂 Taq酶、10×buffer、MgCl2、dNTP、30条随机引物均为上海Sangon公司产品,marker为大连宝生物公司产品。
3.仪器 PCR仪为PTC-100TM(MJ Company USA),电泳仪为Bio-PAD 500/
200型,凝胶自动成像系统为上海Tanon公司GIS 2010型。
4.基因组总DNA的提取 取中国地鼠尾部组织置于1.5ml离心管中,剪碎,每管加入500μl的裂解液TNES(TNES成分:10mmoL/L Tris,pH7.5,400mmol/L NaCl,100mmol/L EDTA,0.6%SDS)35μl的蛋白酶K(10mg/ml)消化。按常规酚、三氯甲烷、异丙醇抽提,溶于适量TE缓冲液溶解,检测DNA浓度,调整至50ng/μl,-20℃保存备用。
5.RAPD反应条件的优化 根据有关RAPD研究报道,设计Taq酶、dNTP、引
物浓度筛选试验和Mg2+浓度、模板浓度筛选试验(表4-1、表4-2)。

6.退火温度和预变性时间设计 热循环扩增条件中主要以退火温度和预变性时间为研究对象。据资料,本实验设计3个程序:(Ⅰ)94℃预变性5min后进入循环体系,94℃变性30s,40℃退火45s,72℃延伸90s。45个循环后接10min延伸。(Ⅱ)94℃变性2min,38℃退火1min,72℃延伸2min,45个循环。(Ⅲ)94℃预变性3min后进入循环体系,94℃变性30s,36℃退火50s,72℃延伸1min,40个循环后接7min延伸。
7.扩增产物电泳分析 取扩增产物8μl在含有0.5μg/ml EB染色液的1.4%的琼脂糖凝胶中电泳分析。
(二)结果
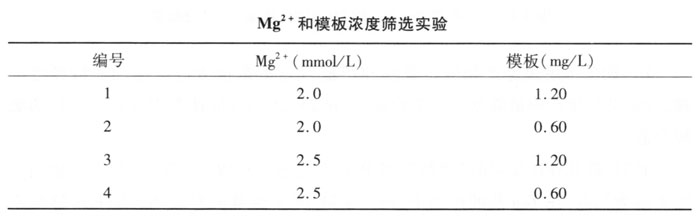
1.Taq酶、dNTP、引物浓度筛选 根据实验设计,进行PCR扩增和电泳检测,部分结果如图4-1所示。Taq酶分为3组:*组为0.04U/μl,第二组为0.08U/μl,第三组为0.06U/μl。结果第二组0.06U/μl扩增条带清晰稳定,相对应的 dNTP为0.2mmol/L,引物为0.2μmol/L,为*佳组合,图4-1中第7、8、9泳道。结果表明:Taq酶、dNTP、引物浓度都对RAPD有影响。
Taq酶的浓度决定产物的特异性和产量,Taq酶浓度太高会增加非特异性产物,过低又会使产物量降低。本实验认为,在25μl的反应体系中加入1.5U的酶较合适。
dNTP是RAPD反应的“原料”,当PCR反应进入扩增延伸阶段时,以引物结合的3'端为起点,在Taq酶的作用下,按与单链DNA碱基配对法则,dNTP延伸结合上去,从而产生不同的片段。dNTP浓度过高会产生错误渗入,增加碱基误配,导致非特异产物增加,RAPD谱带中非特异带增加;dNTP浓度过低RAPD的产率太低,表现为RAPD谱带中明带变强,弱带消失,因此过低或过高都会影响扩增结果的准确性。本实验中我们分别在dNTP浓度为150、200和250μmol/L的情况下进行 RAPD,发现dNTP浓度为200μmol/L时扩增结果较理想。引物浓度也需要适量,反应体系中含有0.2μmoL/L的引物即可。由于RAPD反应使用的是单一的随机引物,所以反应体系中使用高浓度引物更有利于造成引物和模板错配的机会,但是引物浓度不宜太高,否则会有非特异性产物产生。
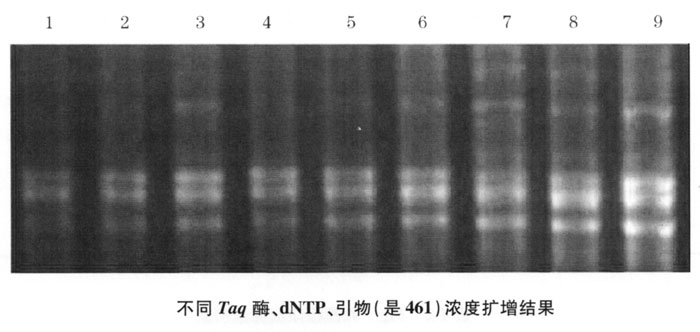
2.Mg2+浓度、模板DNA浓度筛选 通过Mg2+和模板DNA浓度筛选实验, PCR扩增,电泳结果见图4-2:1、2泳道为Mg2+浓度2.0mmoL/L、模板DNA浓度1.20mg/L,3、4泳道为Mg2+浓度2.0mmoL/L、模板DNA浓度0.60mg/L,5、6泳道为Mg2+浓度2.5mmoL/L、模板DNA浓度1.20mg/L,7、8泳道为Mg2+浓度2.5mmoL/L、模板DNA浓度0.60mg/L。其中3、4泳道效果均比较好。
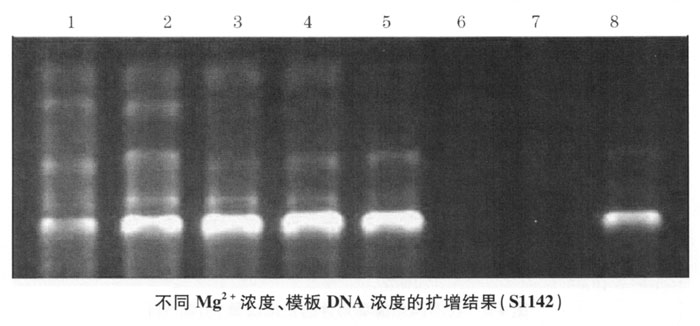
从本研究和有关资料表明,Mg2+浓度过高或过低均会影响扩增结果,Mg2+浓度主要通过影响Taq酶的活性间接影响RAPD扩增。Mg2+是Taq酶的激活剂,Mg2+浓度过低对Taq酶的活化作用不够,过高又会抑制该酶的活性。Mg2+除直接影响PCR的特异性和效率外,也有利于引物和模板的结合及增加引物和模板结合后的稳定性,这对于使用非特异性引物的RAPD反应来讲,Mg2+显得更重要。但是反应体系中所示Mg2+浓度,并不一定是参加反应的游离Mg2+浓度,因为反应体系中DNA模板的浓度、纯度、引物、dNTP均会影响Mg2+浓度。因此,在优化Mg2+*适浓度时应设置几个浓度梯度来精确其*适浓度。经本实验筛选认为Mg2+浓度为2.0mmoL/L时扩增结果较好。
基因组DNA要求纯度高,质量好,这是保证扩增效果佳、重复性好的先决条件。DNA在制备过程中若残留过多的酚、三氯甲烷、乙醇、蛋白质等均对RAPD有影响,因为这些物质直接影响Taq酶的活性;另外,本文作者还发现降解了的模板 DNA对模板浓度很敏感,即不同的浓度会出现不同的扩增式样,其影响的程度还在研究考察中,因此RAPD技术在研究因各种原因DNA发生降解的材料时可能受到一定的限制。
3.热循环条件的筛选 根据退火温度和预变性时间研究中设计的3个程序进行扩增,电泳结果见图4-3。1、2、3泳道为Ⅰ扩增程序的结果,4、5、6为Ⅱ扩增程序的结果,7、8、9为Ⅲ扩增程序的结果。Ⅲ扩增程序结果较好:即94℃预变性3min后进入循环体系,94℃变性30s,36℃退火50s,72℃延伸1min,40个循环后接7min延伸。扩增产物*后在4℃保存。
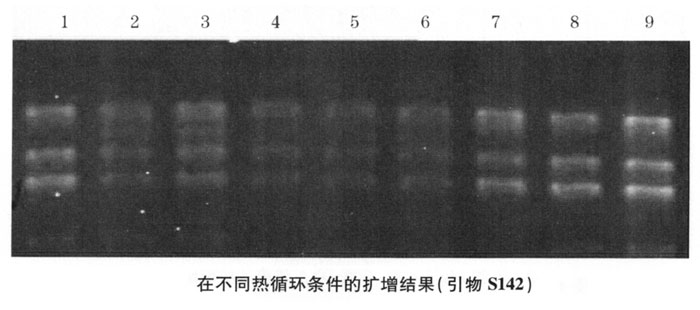
在RAPD体系中不同模板DNA,不同引物,其*适退火温度不同。实验中我们采用引物分别与中国地鼠的模板DNA反应,在退火温度分别为36℃、38℃和40℃条件下进行RAPD,发现在40℃时有阴性结果出现。根据所用引物含G+C含量计算退火温度,决定温度不超过40℃。并且据文献报道,RAPD随退火温度的升高,结果阴性率逐渐增多,在45℃退火条件下,结果阴性率不但更高,RAPD谱带反而变弱,说明随退火温度的升高,引物和模板结合的特异性增强,结合的几率减少。反之,引物和模板结合的特异性降低,结合的几率增加。考虑到既要尽量避免出现阴性结果,又要增强结果的特异性,我们认为退火温度为36℃较适宜。
RAPD循环次数的多少直接影响扩增产物的量及结果的特异性,循环次数少,产物量少;循环次数太多,则有非特异性产物产生。因为PCR反应到达一定程度后,会产生平台效应。过多的循环会增加非特异产物的数量和复杂性,本实验认为循环次数为35~40次足够。
根据以上实验,确定中国地鼠RAPD反应体系及温度循环参数*佳组合为:在25μl的反应体系中含有10×buffer 2.5μl,dNTP 0.20 mmol/L,Mg2+ 2.0mmol/L,引物0.12μmol/L,Taq酶1.5U,模板DNA 15ng,扩增程序为94℃预变性3min后进入循环体系,94℃变性30s,36℃退火50s,72℃延伸1min,40个循环后接7min延伸。
(三)讨论
RAPD的基本反应程序就是PCR反应,因此只有研究出*佳反应条件,才能获得理想的RAPD图谱。对RAPD-PCR的影响因素很多,除本实验涉及的因素外,还应注意以下几个方面:
1.应设立空白对照 RAPD实验过程中,每次扩增反应设立不加模板的空白对照十分必要,这样可以排除实验操作过程中空气、实验器皿或试剂以及操作者带来的污染。在空白中少量带的出现也很常见,原因是Taq酶来自嗜热水生菌,经生物工程制备并提纯,在此过程中带有少量工程菌的DNA,使得在不加反应样本模板的情况下也出现扩增,这样的带在各个样品中出现时带型统计应予以排除。
2.*好使用同一厂家同一批次的试剂 本实验中发现不同来源不同批次的 Taq酶,其活性有差异,在RAPD扩增中尽可能采用同一种Taq酶,避免中途更换,这点很重要。不同厂家生产的反应缓冲液成分的细微差异,甚至即使同一厂家生产的缓冲液,若使用的Mg2+、Taq酶与之不匹配有时也影响RAPD。
3.实验人员素质 实验人员素质的差别对反应也有影响,但是只要条件稳定,操作中养成严谨的态度,对影响因素引起足够的重视,其结果是具有重复性的, RAPD技术本身是稳定的。