
治疗性血管生成(therapeutic angiogenesis)自20世纪90年代起成为冠心病研究的热点之一。在当时药物治疗、介入治疗、外科治疗手段均已相当成熟的背景下,人们发现,仍然有相当数量的冠心病患者由于冠脉病变严重、弥漫而不能受益于已有的治疗方法,如缺血性心肌病的患者。国内外研究者进行了大量研究,应用具有促进毛细血管新生、促进侧支循环建立作用的细胞因子进行“生物搭桥”,试图在严重缺血的心肌建立新生的血管网。为了进行这些研究,建立模拟晚期冠心病患者心脏情况的慢性心肌缺血模型就成为必要的基础。
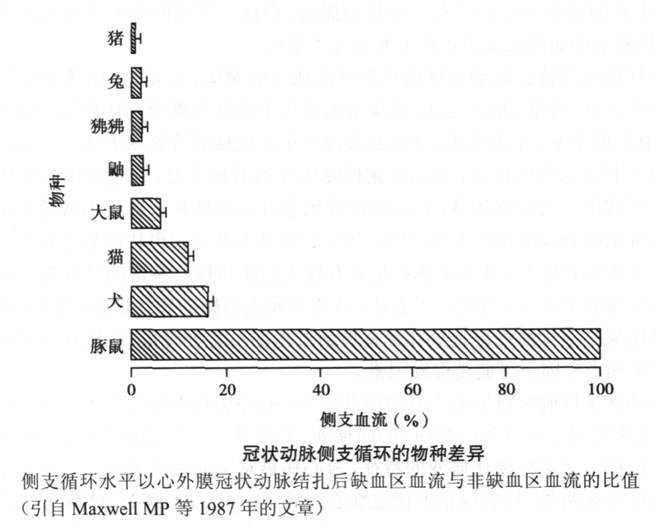
(一)实验动物的选择 Maxwell等在1987年发表的文章中描述了不同种类哺乳动物中侧支循环的存在情况。这项研究显示,既往在心肌缺血的动物研究中*常用的动物犬正常时即存在大量的侧支血管,在冠状动脉急性闭塞后,依赖原有的侧支血管仍能够为心肌提供高达正常时40%的血流灌注,这与人类冠状动脉的情况有很大差异。因此,在近些年的慢性心肌缺血研究中,猪成为应用*多的大动物模型(图6-1)。
猪的冠状动脉解剖结构与人类非常相近,原有的侧支血管很少,冠状动脉分布与人类接近,多数为右冠优势型,猪心脏的传导系统也与人类非常相似。在动物实验中常用的体重30kg左右的小型猪,心脏大小与体重的比值约为0.005,也与人类相近。另外,从代谢方面,猪的心脏也与人类相似,在正常状态下,心肌的代谢主要以非酯化脂肪酸为底物,为心肌提供近80%的能量。在严重心肌缺血的情况下,脂肪酸氧化减少,同时糖利用增加。这些解剖和生理的因素,决定了在心肌缺血的研究、特别是在治疗性血管生成的研究中猪成为更为常用的动物模型。
目前大多数的实验室不再使用普通家养猪作为研究的材料,因为这类猪存在很多问题,如在应激状态下容易出现高热和室颤、不适应实验室环境、生长过快等。目前,通过各种方法培育的小型猪广泛应用于研究中,尤其是在进行慢性实验时,小型猪体重增长缓慢,并能克服上述缺点而适用于实验研究。在进行促血管生成的临床前研究中推荐应用小型
猪。国内也有多家养殖中心可以提供适合动物实验的小型猪,如中国农业大学实验动物中心等。
(二)模型建立方法 目前,应用较为广泛的慢性心肌缺血动物模型主要有以下3种:Ameroid缩窄环模型(Ameroid constrictor),固定狭窄模型(fixed stenosis),及液压闭合器模型(hydraulic occluder)。
1.Ameroid缩窄环模型(图6-2~图6-4)此模型是目前应用*为广泛的慢性心肌缺血模型,特别是在大量的治疗性血管生成的临床前研究中应用。促血管生成蛋白(如重组的血管内皮生长因子、碱性成纤维细胞生长因子、自体骨髓干细胞移植、促血管生成的基因治疗以及心肌激光打孔治疗等治疗方法的动物实验研究均大量应用此模型。

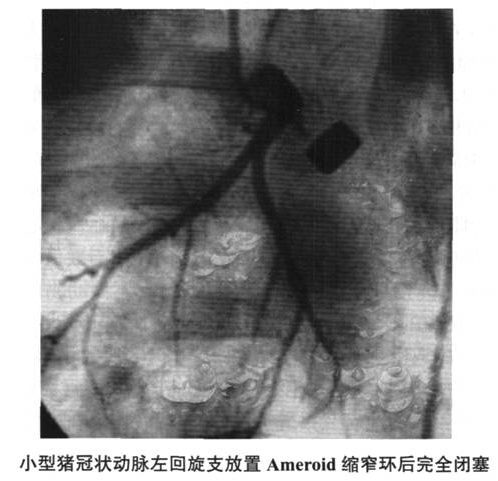
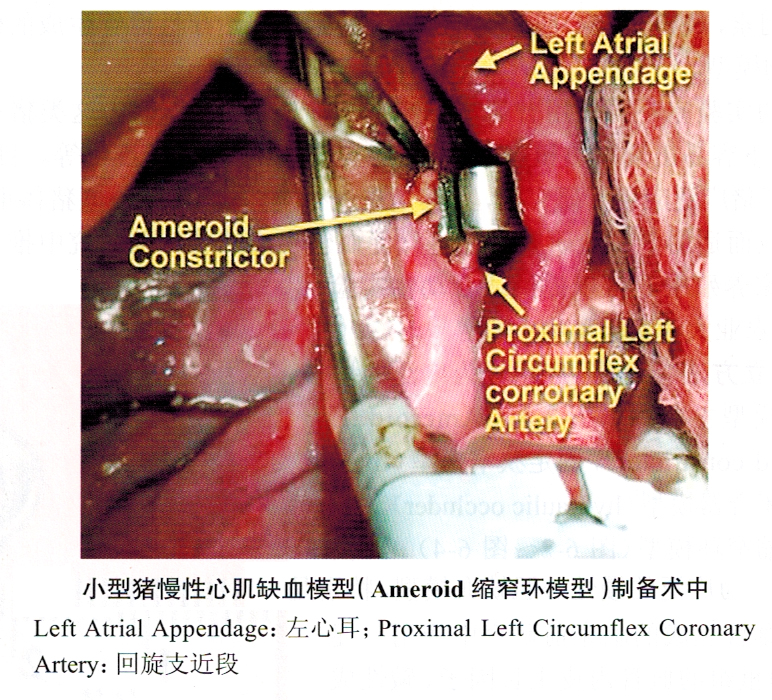
此模型*早在1957年由Litvak等提出,缩窄环由酪蛋白吸湿物制成、外包钢制套环。缩窄环放置在冠状动脉周围后,吸湿物吸收组织间液并向内膨胀,压迫动脉并在2~4周后造成冠状动脉的完全闭塞。由于缩窄环引起的外源性压迫可能导致血管内皮的损伤,引起血小板聚集、血栓形成,异物反应形成的局部瘢痕形成等,*终可能不能如期形成慢性的血管闭塞,而出现未预期的急性闭塞。
通常,出于安全性的考虑,缩窄环放置在冠状动脉左回旋支(left circumflex,LCX),这支血管在猪是三支冠脉主干中*小的,约供应左室心肌的20%:另外,LCX供血范围内原有的侧支血管较前降支和右冠脉丰富。即便如此,术后因室颤或大面积心肌梗死而导致猝死的可能性仍然存在,在报道了动物死亡率的研究中术后因室颤或大面积心肌梗死而导致猝死占实验动物死亡原因的30%。多数与缺血相关的猝死发生在缩窄环*终闭塞的阶段。如前所述,与犬类不同,猪自身原有的冠脉侧支血管很少,因此,它们对冠脉急性闭塞的耐受性很差,会引起大面积的心肌梗死并导致死亡。猪LCX的急性闭塞会造成相应区域75%的心肌坏死并导致35%的死亡率,而在犬类相应的比例只有50%和13%。当然,放置缩窄环后通常出现的是血管的缓慢闭塞,这时,侧支循环会逐渐建立,能够预防或限制心肌梗死的发生。由于在体内缩窄环闭塞的速度并不均一,报道的缺血区域心肌梗死的比例有很大差异。O'Konski等观察在猪的LCX放置缩窄环后,3周后缺血区域发生梗死的比例是37%±36%。心肌梗死主要发生在心内膜下。可以看到,不同动物间心肌梗死的范围差别很大,缺血区心肌发生梗死的比例是5%~100%。在其中一个亚组中,动物在实验过程中服用阿司匹林,这组的心肌梗死范围有缩小的趋势(缺血区心肌的17%±6%)。同一实验室报道的另外一个随访研究中,LCX供应范围心肌梗死的比例仅为5%±1%,作者认为与手术中减少对冠脉的操作有关。其他研究报道的LCX供应范围缺血区发生心肌梗死的比例在6%~13%。
在现有的动物模型中,Ameroid缩窄环模型应用*为广泛,目前对于冠状动脉侧支循环的认识大多是从应用该模型进行的研究中得到的。为了确定模型的适用性,对于LCX闭塞后局部心肌血流灌注及心肌功能的变化进行了很多研究。O'Konski等应用放射性微球[在实验研究中是测量局部心肌血流量(myocardial blood flow, MBF)的金标准,将在第三节“动物模型介绍”中详述]进行的研究发现,放置缩窄环后3周,LCX供应范围内心肌的局部全层MBF与左心室无缺血的区域没有差别;但在负荷的情况下,该范围内心肌的局部全层MBF较对照下降42%,提示冠脉血流储备受损。大量应用放射性微球测定MBF的其他研究也都一致地发现在放置缩窄环3~4周后,LCX供应范围的心肌在静息状态时的灌注是正常的,而负荷时缺血区心肌MBF较非缺血心肌降低。部分研究者对放置LCX缩窄环后心内膜、心肌中层和心外膜的血流情况分别进行测定,发现术后16周时静息状态下LCX供应范围与正常区域无明显差别,而在负荷的情况下,LCX供应范围内各层心肌的血流都较非缺血心肌明显减少。Goerge等发现术后4周时,给予腺苷扩张冠脉侧支循环时,侧支血管提供的血流约为正常*大血流的20%,8周后这一水平可上升至50%~60%,但直到术后26周不再增长。总的来说,此模型造成的心肌血流灌注减少仅发生在负荷状态下。
除了对血流灌注的直接测定外,研究者还应用声纳微测量法来测定室壁局部室壁增厚率来反映局部心肌的功能。Shen和Vatner进行了一项非常精细的研究,在放置LCX缩窄环后每天用超声晶体(ultrasonic crystals)测定局部心肌功能,发现收缩期室壁增厚率的下降高峰(基线的56%±6%)在术后(20±3)天,以后逐渐恢复到正常,到(34±2)天时,局部室壁增厚率与基线就没有差别了。他们同时指出,室壁收缩功能下降的高峰时间的差异也提示缩窄环闭塞时间的不同,而局部室壁功能恢复正常对于模型成功有重要意义。大量其他研究也显示,在静息状态下,由于心肌血流没有减少,放置缩窄环后3周以后,LCX供应范围心肌的局部室壁增厚率与对照区域相似;而负荷时LCX供应范围内局部室壁功能较基线和对照区域均明显降低。这些变化在术后至少16周均保持稳定。因此,从心肌功能的水平来看,Ameroid缩窄环模型仅在负荷状态下表现出缺血所致的心肌收缩功能减退。
White等详细观察了LCX缩窄环放置后形成的侧支血管的形态学和功能。放置缩窄环后3周,来自另外两支冠脉分支(冠脉间)及心脏以外血管(心外)如支气管动脉、乳内动脉等的侧支血管的数量明显增加。冠脉间侧支血管的直径大多在20~60μm,中层厚度为正常小动脉的50%~70%(血管壁内的平滑肌明显较少),而心外的侧支血管直径更大、管壁较厚(中层厚度为正常的80%)。侧支血管的数量和大小在术后3~8周均会明显增加,以后保持稳定直到术后16周。冠脉间的侧支循环均匀地分布在心内膜和心肌中层,在后乳头肌周围较为密集,而心外的侧支循环主要分布在心外膜。心外的侧支循环较冠脉间侧支循环的数量少。这些侧支血管与冠脉闭塞前原有的侧支血管相比,能够增加14倍的侧支相关的血流,其中心外的侧支循环提供的血流约占30%。对内皮细胞和平滑肌细胞进行的DNA标记研究显示,放置缩窄环后2~3周,内皮细胞和平滑肌细胞的标记指数均增加50~70倍,与侧支循环的建立一致,而在术后8周相应的标记指数会恢复到基线水平,提示这一过程中有内皮细胞和平滑肌细胞的显著增殖。犬类的侧支循环是“成熟”的血管,有正常数量的中层平滑肌细胞,放置缩窄环后,依靠侧支循环能够恢复正常的血流灌注,即使在负荷的情况下仍能满足供血的需要。而猪则不同,猪的侧支血管缺乏平滑肌细胞,对血管扩张剂及负荷的反应是不确定的,因此是有限的侧支循环,这就解释了为什么猪的Ameroid模型在负荷条件下可以诱发缺血。
相对于其他慢性心肌缺血模型,Ameroid缩窄环模型建立的手术操作比较简单,这是其主要的优势。但是,这一模型也有其固有的局限性。首先,从模型建立过程来说,该模型中冠脉闭塞的速度和程度无法精确控制,有时闭塞太早,有时又不能达到完全闭塞。这可能导致缺血区域心肌坏死比例的显著的个体差异,也导致那些血管闭塞速度过快的动物发生死亡,因而在部分研究中出现高达30%的死亡率。其次,如前所述,尽管原有的侧支循环很少,在放置血管缩窄环造成冠脉闭塞后,猪的心脏还是能够较快地形成侧支血管,并在3~7周后使静息时的血流和局部心肌功能恢复到正常水平,只有在心肌氧耗量增加,如运动负荷时,才会出现心肌血流的减少及左室局部心肌功能的障碍,因此,这一模型实际上是一个负荷诱发缺血的模型。而在治疗性血管生成研究所针对的冠心病晚期患者,相当数量的患者存在静息时的心肌缺血,以及由于长期慢性缺血导致的心肌冬眠现象,这是Ameroid缩窄环模型所无法模拟的,这可能对应用这一模型进行的研究的结果造成影响。此外,由于这一模型模拟的是负荷诱发的缺血,所有应用这一模型的研究都必须评价负荷情况下心肌的血流灌注和功能,才能够得到准确的结论,这无疑增加了研究过程的复杂性,也使得研究成本明显提高。
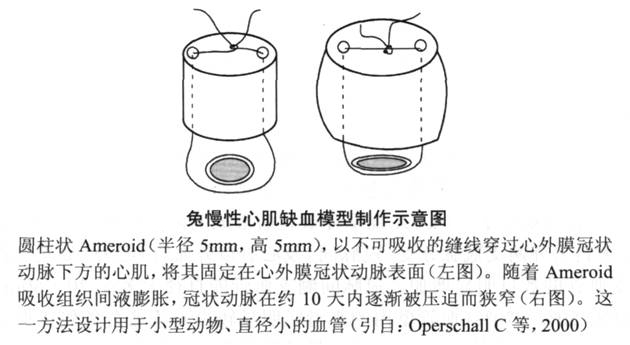
除在大动物如猪和犬应用Ameroid缩窄环以外,曾有研究者建立了类似的兔慢性心肌缺血模型。由于兔心脏体积小,不可能应用缩窄环,因此他们将缩窄环的填充物制成小的压件,穿线后固定在兔冠状动脉上方,通过填充物的膨胀实现冠脉的慢性闭塞(图6-5)。
2.固定狭窄模型 与Ameroid缩窄环模型不同,固定狭窄模型从未在促血管生成治疗的研究中应用,而是广泛应用于研究冬眠心肌的病生理改变。与Ameroid模型不同,应用固定狭窄模型时,冠状动脉的严重的固定狭窄会导致相应供血区域的MBF在静息时显著下降。产生这种差异的原因可能是因为血管狭窄程度较轻时侧支循环形成较少。之前在猪进行的研究中的确发现,在没有发生冠脉完全闭塞的情况下不会形成明显的侧支循环。这与人类的情况相似,人类通常只有在心外膜冠脉狭窄超过90%时才会形成显著的侧支循环,尽管在个体之间存在差异。
建立固定狭窄模型的方法通常是用某种方法将冠状动脉绑扎到一个固定的尺寸。Chen等用丝线结围绕前降支的近端,缩小动脉的外径,使得狭窄血管供应区域的静息血流减少40%。血流的减少可以稳定24小时,并且伴有LAD供应区域室壁增厚率的显著下降。组织学显示仅有很少或没有心肌坏死发生(缺血区域的6%),超微结构的改变包括肌原纤维的部分丢失和线粒体及糖原的增加,符合冬眠心肌的特征。24小时后将固定狭窄去除,室壁运动在一周后恢复,超微结构也恢复到正常,均证实狭窄冠脉分布区域的心肌发生了缺血后仍然存活。在后来的一项研究中该实验室发现这种LAD固定狭窄模型造成的血流减少和局部室壁运动异常在术后4周内可以保持稳定。与前一项研究相同,4周后缺血区域只有很少或没有心肌坏死(6%)。另一发现是在狭窄冠脉供应的范围中可见进行性的心肌凋亡,主要发生在心内膜下心肌。这一发现提示在慢性缺血但仍存活的心肌中会发生细胞凋亡,凋亡可能导致心肌细胞的丢失并在慢性冬眠心肌的纤维化中起一定作用。在进行促血管生成治疗研究时,应对凋亡的过程给予关注,因为从造成冠脉狭窄到给予治疗手段的时间较长,可能发生心肌细胞凋亡而导致细胞丢失,即便治疗手段能够增加冠脉血流灌注,也不能获得良好的改善局部心肌功能的作用。关于这一点,在Lai等应用同一LAD狭窄模型的研究中也被强调提出。这些研究者发现,在造成冠脉狭窄后的4周中,发生了进行性的左室重塑,心室容积、质量增加、间质纤维化出现。经过3周的再灌注后这些改变部分可逆。作者认为,如果在严重血管狭窄后没有及时再血管化,局部的室壁变薄、左室容积增加会引起室壁张力的增加,可能通过神经内分泌机制引起进行性的心肌细胞退变和纤维化。
Fallavollita等应用相似的冠脉固定狭窄模型进行研究,将一内径固定(1.5~2.25mm)的缩窄环放置在幼年猪(体重平均8kg)的LAD近端,3个月后观察。处死时动物的体重平均为75kg。3个月后的冠状动脉造影显示冠脉完全闭塞的比例很高,由于放置缩窄环时动物还未长大,血管直径也较小,所以在3个月后出现这一结果在意料之中。随着动物的成长和血管直径的增大,可以预期会出现放置缩窄环部位的血管狭窄。放置缩窄环后3个月,局部室壁运动显著减弱,左室造影显示严重的室壁不运动或运动低下。放射性微球实验显示局部心肌血流灌注显著减少(心内膜下心肌灌注减少24%,全肌层MBF减少11%)。光镜下组织学检查未发现明显的心肌坏死(仅占缺血区的6%),功能减低的区域心肌收缩可以恢复,也提示心肌仍存活。同时,局部的PET荧光脱氧葡萄糖(FDG)显像也显示LAD供血区域的心肌有FDG摄取,提示心肌缺血但仍存活,其中在心内膜下心肌FDG摄取*为明显。冠脉造影显示近端闭塞的LAD可以依靠侧支循环充盈;侧支血管的来源包括桥侧支、LCX和RCA。未发生LAD完全闭塞的动物在造影时没有发现侧支循环的形成。在另一项研究中,Fallavollita等观察了制作相同模型后1个月和2个月时的情况,术后1个月LAD的平均狭窄程度为74%±5%,2个月时为83%±6%。用彩色微球测定MBF显示,术后1个月和2个月时LAD供应范围的静息血流灌注都是正常的。但在同样的区域里,静息时的室壁运动明显减弱,提示慢性顿抑。用血管扩张剂检测冠脉血流储备在1个月时轻度降低,至2个月时明显降低。1个月时FDG摄取没有显著变化,而至2个月时明显增加,符合存在缺血并存活的心肌。基于以上两项研究的结果,可以看到狭窄程度和狭窄存在的时间共同决定狭窄冠脉供应范围在静息时MBF是否能够维持正常,这两个因素在设计促血管生成治疗的研究时必须纳入考虑。
固定狭窄模型的主要优势是在所有的动物可以获得相对均一的缺血程度。另一优点是在静息状态下狭窄冠脉供应范围内心肌血流灌注和功能就会降低,这样可以为促血管生成治疗效果的评价提供一个额外的指标。此模型的主要缺点是由于操作技术要求相对较高、迄今为止在治疗性血管生成的研究中应用较少。
3.液压闭合器模型(hydraulic occluder model) 另一种慢性心肌缺血的大动物模型应用一种可调节的液压闭合器,将其放置在心外膜冠状动脉的周围以形成固定程度的冠脉狭窄。这一模型同样是利用外压的方式造成冠脉狭窄,但在应用这一装置的同时通常要放置一个心肌血流探测器。闭合器的近端与体外相通,术后用气体或液体的填充物使闭合器膨胀,可以通过探测冠脉血流精确地调节冠状动脉的狭窄程度。Bolukoglut是*早应用这一模型模拟冬眠心肌的研究者之一。他们将多普勒血流导丝和液压缩窄环顺序放置在前降支近段。缩窄环在术中即被填充,使多普勒导丝测定的血流速减少50%。这种狭窄程度要维持7天。他们报道的围术期死亡率高达44%,多数是由于缩窄环膨胀后造成冠脉痉挛导致的恶性心律失常。7天后存活的动物中,缺血区域收缩期缩短率降低40%,没有酸中毒和细胞死亡的证据,小剂量多巴酚丁胺注射后收缩功能能够恢复,组织学上没有心肌梗死的表现,均提示这一模型中LAD供应范围为慢性缺血但仍存活的心肌。有趣的是,在放置缩窄环的LAD近段的横切面可以看到血管外膜和中膜的损伤,内皮下成纤维细胞增殖。这种血管内结构的变化可能是很重要的,可能是永久性的,因为即使在充盈缩窄环7天后将其放松,局部血流速度仍然维持在缩窄环充盈时的水平,不能恢复。对于前述的两种模型可能也存在同样的情况。
St.Louis等对Bolukoglu的模型进行了一些改造,将超声探头放置在LCX近段液压缩窄环远侧,测定下游的MBF。超声探头测定血流量非常精确,能够帮助精确调节血管的狭窄程度,对血管不造成损伤。在这一模型中,放置液压缩窄环后不立即充盈,待动物恢复几天后才将缩窄环充盈,以避开手术应激对动物的影响。与Bolukoglu等的模型相比,这一方式使得动物发生恶性心律失常的比例大大下降,仅约1%。这一模型被多次应用于研究冬眠心肌的病生理机制、促血管生成治疗、激光心肌血运重建等研究。缩窄环充盈造成 LCX近段严重狭窄后,远端动脉血流减少90%,维持慢性缺血状态后,应用13 NH3-PET定量测定的LCX供应范围心肌的透壁MBF下降25%~30%。这种血流水平和MBF的变化可以在长达6个月的时间内基本保持不变。[18F]FDG-PET也显示LCX供应范围持续的FDG摄取增加120%~140%,提示该范围心肌缺血但仍存活。经食管超声检查会发现LCX供应区域静息时室壁运动明显低下。在小剂量多巴酚丁胺注射后,该区域的室壁运动较静息时明显改善,而继续给予大剂量多巴酚丁胺时又出现明显恶化。这种对多巴酚丁胺的双相反应是缺血的存活心肌的特征。组织学检查显示缺血区仅有极少的心内膜下心肌坏死(0%~8%)。光镜下可以发现心肌细胞内收缩物质的减少,肌丝被糖原所替代,胞浆内散在着小线粒体,胞核变形、可见异染色质,这些超微结构的变化均是慢性缺血的存活心肌的特征。在心内膜下心肌这些表现更为显著。
液压闭合器的主要优势是由于使用超声血流探测的辅助,对狭窄程度可以精确地调节,从而能够形成持续稳定的缺血。另外,术后几天后、待动物从手术应激中完全恢复、去除了导致冠状动脉痉挛的刺激因素后再充盈缩窄环,能够更准确地确定狭窄的程度。另一优点是在术后仍然可以对血管狭窄的程度进行调节,这一点是固定狭窄模型所不能实现的。同固定狭窄模型一样,这一模型也能够造成静息状态下心肌灌注的减少,便于对血流灌注改善的判断(MBF)。经过改造的模型围术期死亡率很低。这一模型的主要缺点是对手术操作的技术要求高,同时要放置缩窄环和超声探头,而长期观察中缩窄环有一体外部分也会增加喂养的难度。
对于各种动物模型,有一个共同的问题:促血管生成治疗应在造成缺血后多长时间进行。如前所述,慢性缺血而仍存活的心肌会发生进行性的细胞凋亡、心室重构包括有收缩能力的细胞减少、间质结缔组织增多。这些改变可能导致缺血区域心室功能的下降,研究显示,如果患者心肌细胞的损伤更为严重,血运重建后心室功能的恢复会受到明显影响。如Beanlands等对存在冬眠心肌的患者进行的观察显示,血运重建延迟的患者在冠脉搭桥术前发生死亡的比例较高,术后左室功能的恢复也较早期手术的患者差。因此,在促血管生成的研究中,动物慢性心肌缺血的时间不应过长,否则,即使在局部心肌血流恢复后,心肌功能也很难恢复,这将影响对促血管生成物质作用的评价。
多种促血管生成治疗在不同的猪慢性心肌缺血模型中被证明有效,包括重组的FGF和 VEGF蛋白、基因治疗、自体骨髓细胞移植及激光心肌打孔等,但在临床实验中远未获得同样理想的结果。实验研究和临床研究之间有如此大差异的原因并不清楚,但可能与模型动物和人类的差别有关。直到*近,慢性缺血时的新生血管形成一直被认为包括小动脉形成(arteriogenesis)和血管新生(angiogenesis)的过程。血管新生是指在原有的毛细血管床上通过出芽方式形成新的毛细血管,主要是由缺血引起,通过HIF的活化,促进VEGF及其受体的表达,提高VEGF mRNA的稳定性而发生。小动脉形成是在原有的小动脉基础上生长出新的小动脉,这种血管生长是侧支血管成熟、形成有血液通过能力的血管的过程,形成的血管在动脉造影时可见。小动脉形成的刺激因素包括血管剪切力及炎症,此时单核细胞和其他白细胞的浸润导致FGF等生长因子的产生并促进血管的生长。近期研究显示,除了以上两种过程,成人的新生血管形成还同时存在血管生成(vasculogenesis)的过程。血管生成是指由一种内皮前体细胞——血管母细胞生成血管组织的过程。血管母细胞迁移并与其他内皮前体细胞和毛细血管融合形成原始的血管网络,也称初级毛细血管丛。随后,初级毛细血管丛进行出芽、分支的重塑,即血管新生的过程。因此,尽管有作者认为小动脉生成是心肌血流明显恢复、显示治疗性血管生成疗效所必需的,但血管新生、血管生成和小动脉形成都可能参与成人心脏新生血管形成的过程。大多数关于小动脉生成的研究都是在如四肢等原有侧支血管丰富的区域进行的,在心脏进行的促血管生成治疗是否也需要原有侧支血管的参与?还是主要依赖真正意义上的新生侧支血管形成?很重要的一点是,小动脉形成是建立在原有小动脉的基础上,在严重的冠心病患者,可能缺乏相应的基础。在这些患者,血管新生和血管生成的过程同样也可能受到损害。
在动物实验研究中,多应用健康的动物、造成单支血管病变,这种情况下,形成新生侧支血管的能力可能比较强,与临床患者的情况有差异,这可能是造成临床试验效果与动物实验结果差别很大的原因。另外,可能需要建立多支血管病的动物模型,对单支病变模型中提示可能有效的方法进行更为严格的评价。同时,新生血管形成是一个由多种活性分子调控的高度有序的生理过程,如可溶性蛋白分子VEGF、促血管生成素、FGF、PDGF、TGF、 INF、CSF等;一些膜结合蛋白也发挥重要的作用;内皮细胞表面的剪切力对毛细血管生成也有调节作用。对于这些调控因素的相互作用以及它们对治疗的作用也应给予充分的重视、作深入的研究。在血管生成的研究中,基因组学和蛋白质组学研究也将占据更重要的地位。在此类研究中,以小鼠或大鼠作为模型动物可能有更多的优势。