
北京大学邓宏魁教授团队在 2025 年延续其在细胞命运调控领域的领跑地位,开年以来累计发表 10 篇高水平研究成果,总影响因子达 130.5,覆盖胚胎发育、肿瘤治疗、肝再生等多个前沿领域。
作为化学重编程技术的奠基人,邓宏魁团队通过系统性创新,持续拓展人类多能干细胞制备的底层技术边界,为再生医学临床转化提供了关键支撑。我们选取了部分 10 分以上的文章进行分享,更多优秀文章欢迎补充!
01
Cell Research
2025年7月4日,北京大学邓宏魁教授与屈默龙、顾晋作为共同通讯在Cell Research(IF=25.9)发表了题为“A patient-derived organoid model captures fetal-like plasticity in colorectal cancer”的研究论文。
该研究聚焦结直肠癌中表型可塑性与胎儿样转录程序的关联,建立了化学成分明确的患者来源类器官系统,为深入研究结直肠癌中癌细胞可塑性的胎儿样特征,及其在肿瘤进展和治疗耐药中的作用提供了可靠工具。

表型可塑性是结直肠癌(CRC)进展、转移及治疗耐药的核心驱动因素,而胎儿样转录程序被认为是促进这种可塑性的关键,但现有研究模型因无法长期保留此类特征而限制了相关机制的探索。
为突破这一局限,研究团队构建了化学成分明确的患者来源类器官系统:通过小分子替代传统培养中不稳定的重组蛋白或动物源因子(如 Noggin、R-spondin 等),实现了结直肠癌细胞的长期扩增,同时稳定保留了与表型可塑性相关的胎儿样特征。
利用该模型,团队鉴定出一种癌胚状态(OnFS):这一状态在晚期肿瘤中高度富集,与上皮 - 间质转化、转移能力增强及治疗耐药性等可塑性核心特征密切关联。机制层面,研究证实FGF2-AP-1 信号通路是维持 OnFS 程序及相关表型可塑性的关键调控轴。
该模型不仅克服了传统类器官培养中胎儿样状态易丢失、信号不稳定等缺陷,更为深入研究结直肠癌中胎儿样特征如何驱动癌细胞可塑性,及其在肿瘤进展和耐药中的作用提供了可靠平台,为开发针对表型可塑性的治疗策略奠定了基础。
02
GUT
2025年3月3日,北京大学邓宏魁、清华大学庞媛作为共同通讯在GUT(IF=23.1)发表了题为“Bioprinting functional hepatocyte organoids derived from human chemically induced pluripotent stem cells to treat liver failure”的研究论文。
该研究针对传统单细胞生物打印肝组织模型因细胞功能不足导致治疗效果有限的问题,开发了一种基于肝细胞类器官的三维生物打印策略,用于肝衰竭治疗。

研究团队以人类化学诱导多能干细胞(hCiPSCs)为细胞来源,通过透氧微孔装置优化氧供应,生成高活力、高功能的肝细胞类器官(hCiPSC-HOs);随后采用基于球体的生物打印技术构建肝组织模型(3DP-HOs),以维持类器官的长期功能。
实验结果显示,3DP-HOs 相比单细胞模型细胞活力更强,基因表达更接近原始类器官,且能稳定发挥肝脏特异性功能。在动物实验中,3DP-HOs 腹腔植入显著提高了两种肝衰竭模型小鼠(CCl4 诱导的慢加急性肝衰竭和 Fah⁻/⁻肝衰竭)的存活率,有效减轻肝损伤、炎症和纤维化,并促进肝脏再生。
该研究证实了生物打印肝细胞类器官模型在肝衰竭治疗中的显著疗效,为肝再生医学的临床转化提供了新方案。
03
Molecular therapy
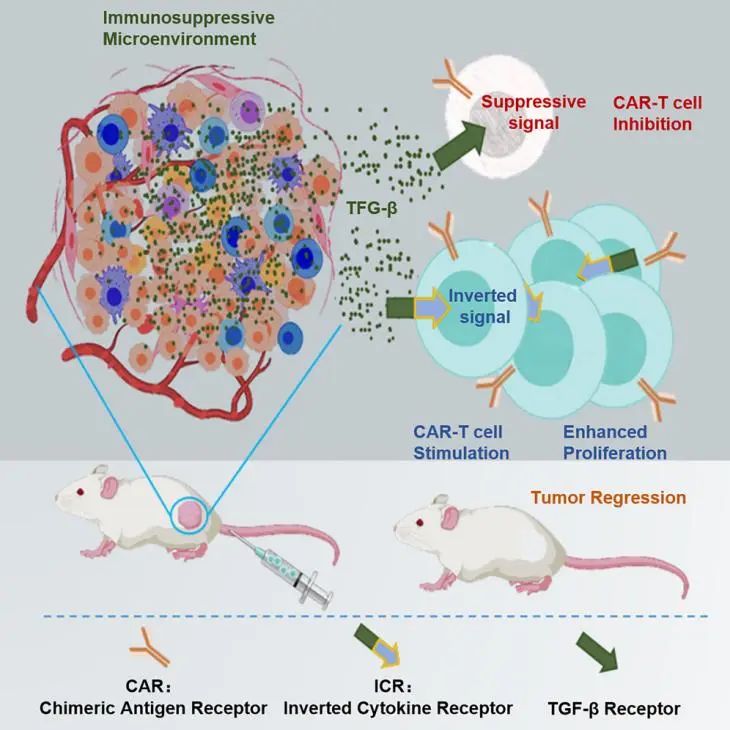
2025 年 2 月 5 日,邓宏魁团队与白云团队合作在Molecular therapy(IF=12)上在线发表了题为“Potentiating CAR-T-cell function in the immunosuppressive tumor microenvironment by inverting the TGF-β signal”的研究论文
该研究创新性设计反转细胞因子受体(ICR)将肿瘤微环境中 TGF-β 的抑制信号转化为 IL-15 的激活信号,突破了实体瘤免疫抑制微环境对 CAR-T 细胞功能的限制,为实体瘤的 CAR-T 细胞治疗提供了新策略。

实体瘤中,TGF-β 主导的免疫抑制微环境会抑制 CAR-T 细胞的持久性和功能,而现有 TGF-β 信号阻断策略疗效有限。为此,研究团队设计了一种新型反转细胞因子受体(ICR)修饰的 CAR-T 细胞策略:将 TGF-β 受体 II 的胞外域与 IL-15 受体 α 的胞内域融合(构建体命名为 TB15),并结合靶向 EGFR 的 CAR,使 T 细胞同时具备 “阻断 TGF-β 抑制信号” 和 “激活 IL-15 刺激信号” 的双重功能。
在高 TGF-β 的结直肠癌小鼠模型中,这种 “信号反转 CAR-T 细胞(EGFR-CAR/TB15 T 细胞)” 一方面阻断 TGF-β 对 CAR-T 细胞的抑制,同时,利用 IL-15 信号促进 CAR-T 细胞增殖、增强其持久性和细胞毒性。实验证实,该策略显著提升了 CAR-T 细胞在实体瘤微环境中的存活与功能,有效抑制肿瘤生长。
该研究创新性地通过合成受体实现 “抑制信号→激活信号” 的反转,为克服实体瘤中 CAR-T 细胞治疗的关键障碍提供了新方案,拓展了合成受体信号在肿瘤免疫治疗中的应用。
04
SCIENCE CHINA Life Sciences
2025 年 1 月 13 日,邓宏魁作为共同通讯作者在 SCIENCE CHINA Life Sciences(IF=9.5) 杂志上发表了题为 “Transient Chemical-Mediated Epigenetic Modulation Confers Unrestricted Lineage Potential on Human Primed Pluripotent Stem Cells” 的研究论文。

研究针对人类始发态多能干细胞(primed hPSCs)滋养外胚层谱系潜能有限的问题,提出通过小分子表观遗传调节剂鸡尾酒短暂处理的策略:经处理的细胞在保留胚胎分化潜能的同时,获得滋养外胚层谱系潜能,可生成滋养外胚层样细胞及下游滋养层干细胞,并进一步分化为合体滋养层和绒毛外滋养层。
转录组和表观遗传分析证实,诱导细胞与体内滋养外胚层及细胞滋养层的转录特征高度相似,且滋养层谱系基因位点的 H3K27me3 抑制修饰减少。机制上,抑制 HDAC2、EZH1/2、KDM5s 等表观遗传调控因子是激活滋养层潜能的关键。
该研究通过短暂表观遗传重置突破了始发态 hPSCs 的谱系限制,不仅揭示了表观遗传调控细胞全能谱系潜能的机制,还为胎盘发育及相关疾病的研究提供了可靠的体外模型。
05
Nature Chemical Biology
2025 年 1 月 3 日,邓宏魁课题组与北京大学关景洋课题组合作,在 Nature 子刊 Nature Chemical Biology(IF=13.7) 上发表了题为“A Rapid Chemical Reprogramming System to Generate Human Pluripotent Stem Cells” 的研究论文。

研究团队通过对比分析不同个体来源的体细胞,难诱导细胞系中组蛋白修饰相关酶 KAT3A/B 和 KAT6A 富集表达,对维持细胞身份至关重要。通过调控这些靶点,团队建立了新的快速化学重编程体系:将高效诱导人 CiPS 细胞的时间从 30 天缩短至 16 天内(最短仅 10 天),在 15 名不同遗传背景、年龄的个体来源体细胞中均实现高效诱导,最高效率达 38%,对原先重编程效率低的供者细胞,16 天内效率提升 20 倍以上,显著增强了技术的普适性。
机制上,抑制 KAT3A/B 和 KAT6A 可加速体细胞相关基因关闭,同时使下一阶段需激活基因的增强子区域处于待激活的表观修饰状态,促进这些基因快速转录;还能快速打破体细胞基因程序,抑制异常激活基因,加速表观遗传修饰变化,实现更直接、普适的细胞命运转变。
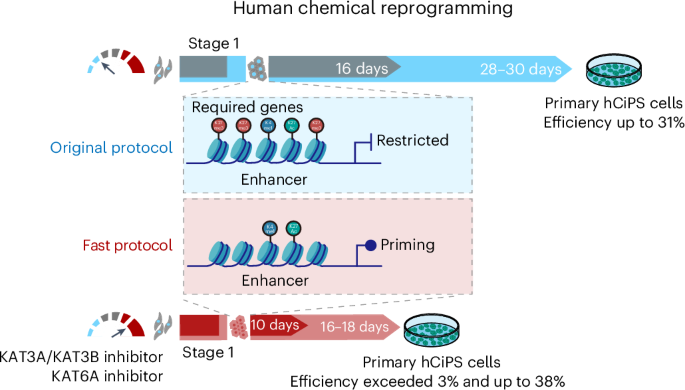
总而言之,该研究完善了化学重编程制备人多能干细胞的方法,提供了快速高效稳定的底层技术体系,为再生医学、临床治疗及个性化医疗的广泛应用奠定基础。