
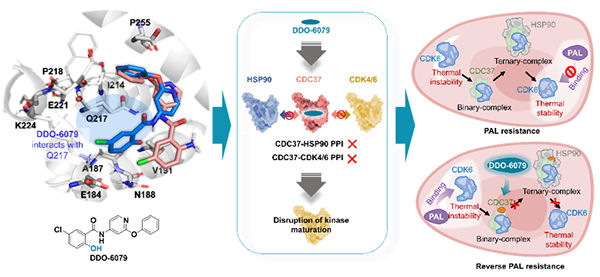
图 DDO-6079变构结合于CDC37并选择性抑制激酶蛋白成熟
在国家自然科学基金项目(批准号:82173741、81930100、82304309、81925034)等资助下,中国药科大学王磊研究员、尤启冬教授团队与上海交通大学张健教授团队合作,在靶向分子伴侣系统药物设计方面取得进展。研究成果以“CDC37变构抑制剂可破坏伴侣复合物以阻断CDK4/6成熟(Allosteric CDC37 inhibitor disrupts chaperone complex to block CDK4/6 maturation)”为题,于2024年11月24日在线发表于《德国应用化学》(Angewandte Chemie International Edition)杂志。论文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202413618。
分子伴侣系统负责调控众多底物蛋白的成熟折叠与翻译后修饰,对生命体正常生理功能的维持至关重要。热休克蛋白90(HSP90)分子伴侣系统的共伴侣蛋白细胞分裂周期37(CDC37)蛋白在HSP90分子伴侣系统中负责招募待折叠成熟的激酶,随后与HSP90蛋白互作,进而将招募的客户激酶递送给HSP90蛋白。CDC37同时结合HSP90和激酶,在肿瘤细胞中过表达,成为潜在的药物靶标。然而,CDC37、HSP90和激酶之间存在复杂的蛋白互作,使得小分子难以同时干预HSP90-CDC37和CDC37-激酶的蛋白互作,目前尚无特异性的CDC37小分子抑制剂报道。
该研究首先构建了体外亲和力与蛋白互作抑制的筛选体系,通过化合物库筛选,发现了具有CDC37结合活性的苗头分子。随后开展了基于结构的药物设计,对苗头分子进行结构改造,获得了结合活性更优的小分子DDO-6079。机制研究发现该分子与CDC37的全新变构位点结合,通过变构调控机制可同时实现HSP90-CDC37 和CDC37-CDK4/6伴侣复合物的协同抑制。DDO-6079可选择性地抑制多种致癌激酶的成熟,同时避免经典HSP90抑制剂的热休克毒副作用。此外,DDO-6079还能够降低CDK6的热稳定性,逆转结直肠癌细胞对palbociclib(CDK4/6抑制剂)的耐药,并在动物体内显示出较强的抗结直肠癌活性(图)。
该研究不仅报道了首个CDC37小分子变构抑制剂DDO-6079,还发现靶向CDC37可降低CDK6热稳定性的全新生物学功能,实现对现有CDK4/6药物耐药的逆转,为精准调控分子伴侣系统提供了研究策略与方法,也为靶向分子伴侣系统的药物设计提供了潜在靶标。