
小核仁RNA(snoRNAs)是一类高度保守的小分子非编码RNA,主要通过引导特定的RNA修饰,如2′-O-甲基化和假尿苷化,来发挥其功能。这些修饰对于确保核糖体RNA(rRNA)、小核RNA(snRNA)等的正常折叠和功能至关重要。然而,snoRNA的功能远不止于此,它们还能够与mRNA等多种RNA分子相互作用,参与调控基因表达、RNA稳定性和翻译效率等多个生物学过程。

尽管snoRNA的重要性已经得到广泛认可,但对其靶向RNA的全面了解一直受到限制。
11月22日,芝加哥大学的何川、潘涛教授团队在顶刊《Cell》发表了一篇题为“snoRNA-facilitated protein secretion revealed by transcriptome-wide snoRNA target identification”的研究论文。
该研究开发了一种创新的基于化学交联的方法,该方法能够在人类细胞和小鼠脑组织中全面检测snoRNA的细胞RNA靶点,揭示了成千上万种之前未曾报道过的snoRNA与mRNA之间的相互作用。这些新发现的相互作用不仅限于已知的snoRNA引导的RNA修饰位点,还涉及到了RNA修饰以外的非经典功能,拓宽了我们对snoRNA功能多样性的认识。

研究亮点
snoKARR-seq揭示了转录组范围内广泛的snoRNA-mRNA相互作用
大部分snoRNA-靶mRNA相互作用不涉及RNA修饰
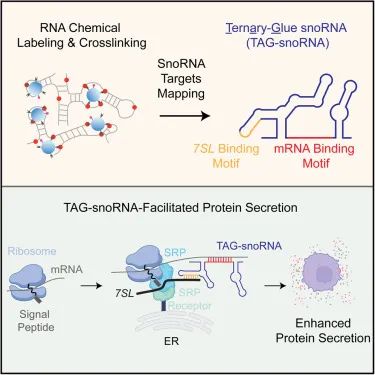
SNORA73 结合 mRNA 和 7SL RNA,充当三元复合体的“粘合剂”
SNORA 73通过mRNA-snoRNA-7SL相互作用促进蛋白质分泌
为什么要研究snoRNA
snoRNA主要通过C/D-box snoRNA和H/ACA-box snoRNA在rRNA和snRNA中进行2′-O-甲基化和假尿苷化修饰,ScaRNA则主要在snRNA中引导这些修饰,稳定其结构并调节与前信使RNA(mRNA)的相互作用以影响剪接。每个snoRNA提供一个或两个指导序列用于rRNA修饰,这些修饰有助于调节核糖体生物发生、密码子识别和核糖体-配体相互作用。
尽管人类基因组中约80%的注释snoRNA缺乏明确的功能,但一些snoRNA可以通过影响mRNA的稳定性、编辑和剪接来调节基因表达。超过50种snoRNA在超过12种癌症类型中失调,SNORD115/116簇的基因组缺失与Prader-Willi症状(PWS)相关,SNORD118的突变导致白质脑病,这些疾病机制仍不完全清楚,主要是由于缺乏有效的工具来鉴定snoRNA的靶标和转录组中靶RNA的修饰状态。
如何检测snoRNA靶标?
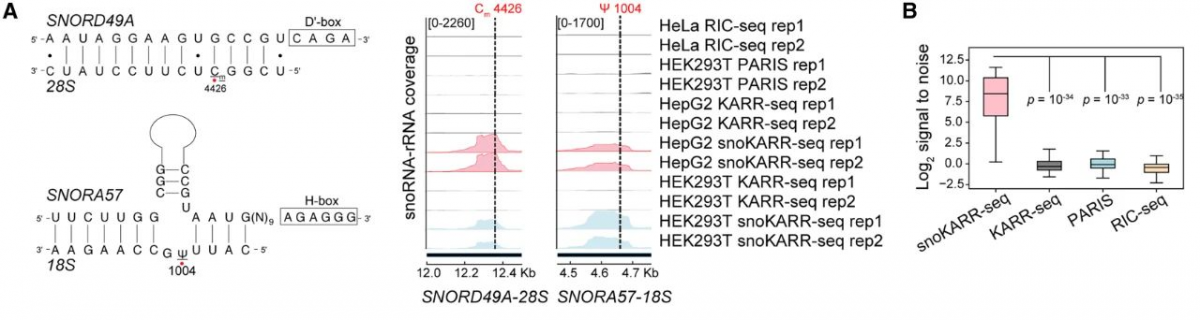
本研究开发了一种称为KARR-seq的方法,利用化学交联剂有效捕获物理上邻近的RNA,而不依赖于局部RNA-蛋白质相互作用。该方法基于酮醛辅助RNA-RNA相互作用测序(KARR-seq)的原理,利用N3-酮醛标记单链RNA(ssRNA)中的鸟苷,并使用二苯并环辛烷(DBCO)修饰的聚胺胺(PAMAM)树状大分子进行RNA化学交联,以捕获RNA-RNA相互作用。N3-酮醛可以标记各种RNA种类,两个标记位点之间的平均距离约为20个核苷酸(nt)。此外,该方法在工作流程中引入了一个源自snoRNA的cDNA富集步骤,显著提高了最终测序文库中含有snoRNA的嵌合读段的检测特异性。
SnoRNA73促进蛋白分泌
研究团队利用该方法在不同的细胞系(HepG 2,MDA-MB-231,A549,PC 3和HEK 293 T)中鉴定了rRNA以外的数千个snoRNA靶标,发现其相互作用位点多发生在非传统RNA修饰位点,说明snoRNA可能存在其他的非经典调控作用。
于是,研究团队选择了具有非典型结构的SNORA 73,它是HepG2细胞中最丰富的H/ACA盒snoRNA之一,且与人类基因组编码的SNORA 73高度相似。
研究团队通过敲低SNORA 73后检测到四种靶蛋白的表达量减少,并通过空间阻断技术验证了SNORA 73通过其mRNA结合基序(MBM)与靶mRNA结合,从而调节蛋白质分泌的非经典功能。

进一步研究发现,SNORA73通过其非经典的RNA结合序列与靶标mRNA形成稳定的二级结构,并与信号识别颗粒(SRP)的关键RNA成分7SL RNA结合,组装成“mRNA-snoRNA-7SL RNA”三元复合体。
SRP是细胞内负责识别新生肽链中的信号肽并将其引导至内质网(ER)进行分泌或膜整合的经典蛋白质转运分子。SNORA73在这一过程中充当“分子胶水”,通过双重RNA-RNA相互作用将SRP复合物与靶mRNA连接,显著提升靶标mRNA与SRP的结合效率,促进翻译复合物的内质网转运,从而提高分泌性蛋白的转运和释放。
实验验证表明,敲低SNORA73的表达会导致其靶向的分泌性蛋白分泌水平显著下降,而非靶向蛋白则不受影响。随后实验结果发现,SNORA73通过促进新生肽链的转运增强蛋白质分泌,而不是通过改变mRNA的丰度或翻译水平,进一步佐证了SNORA73的“胶水”作用。

该研究创造性地提出来更加准确的snoRNA分析方法,为后续snoRNA相关研究提供了范本,参考研究中将SNORA 73靶向修饰的绿色荧光蛋白(GFP)mRNA,显著提高了GFP的分泌效率。
未来或可通过人工设计和改造snoRNA,可以增强特定蛋白质的分泌效率,为生物治疗蛋白的生产提供新思路。其机制研究也有助于深入理解RNA修饰和调控的分子机制,为多种疾病的诊断和治疗提供了新的靶点和策略。