
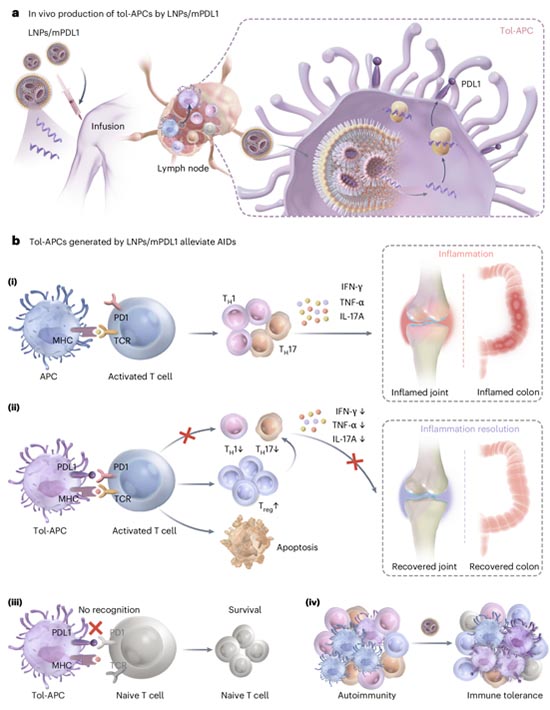
图 低免疫原性递送PDL1 mRNA在体生成耐受性抗原提呈细胞(tol-APCs)技术示意图。(a)低免疫原性脂质纳米颗粒(LNPs)递送PDL1 mRNA在体生成tol-APCs的过程;(b)生成的tol-APCs通过PDL1/PD1通路选择性抑制活化T细胞,有效缓解自身免疫病症状
在国家自然科学基金项目(批准号:52025036、82173390、52495014)等资助下,中国科学技术大学生命科学与医学部王育才教授团队在低免疫原性脂质纳米颗粒(LNPs)递送mRNA实现体内生成耐受性抗原提呈细胞(tol-APCs)的研究中取得进展。相关研究成果以“脂质纳米颗粒递送PDL1 mRNA在体生成耐受性抗原提呈细胞(Generation of tolerogenic antigen-presenting cells in vivo via the delivery of mRNA encoding PDL1 within lipid nanoparticles)”为题,于2025年3月28日在线发表于《自然·生物医学工程》(Nature Biomedical Engineering)杂志上,论文链接:https://www.nature.com/articles/s41551-025-01373-0。
“在体细胞工程”技术被认为是未来精准免疫治疗的重要方向,该技术无需通过体外操作即可实现靶细胞的功能重编程,具有可规模化、标准化、低成本的优势。基于这一新兴理念,该研究开发了一种低免疫原性LNP递送平台,通过系统调控其N/P比与组分配比,实现对PDL1 mRNA的高效、靶向递送,并显著减少纳米颗粒本身对免疫系统的刺激。该系统能够在体内高效编程抗原提呈细胞,使其获得tol-APCs表型,有效诱导致病性T细胞失能并促进调节性T细胞扩增。在类风湿性关节炎和溃疡性结肠炎等自身免疫病动物模型中,该策略所产生的tol-APCs表现出显著的治疗效果,能够精准调节免疫平衡、抑制疾病进展。这一策略突破了传统体外诱导tol-APCs方法操作复杂、成本高昂、个体定制难以普及的问题,显著提升了技术的临床可行性。
与当前广泛用于疫苗的常规mRNA递送系统相比,该研究开发的低免疫原性LNP系统在递送效率与免疫耐受之间实现了平衡。其特点是在保持高效mRNA表达的同时,避免了APCs激活为免疫成熟表型(如CD80/CD86/CD40等共刺激分子的上调),这是实现tol-APCs体内诱导的关键。该研究不仅为自身免疫疾病治疗提供了全新的策略,也为“在体免疫细胞工程”这一前沿方向提供了技术支撑,具有广阔的临床转化前景。